- Biển số
- OF-359543
- Ngày cấp bằng
- 23/3/15
- Số km
- 1,090
- Động cơ
- 266,381 Mã lực
BÀI SỐ 333: TIẾP TỤC THÊM MỘT PHÁC ĐỒ TIÊU CHUẨN ĐƯỢC THIẾT LẬP CHO BỆNH NHÂN UNG THƯ PHỔI DƯƠNG TÍNH ĐỘT BIẾN GEN EGFR.
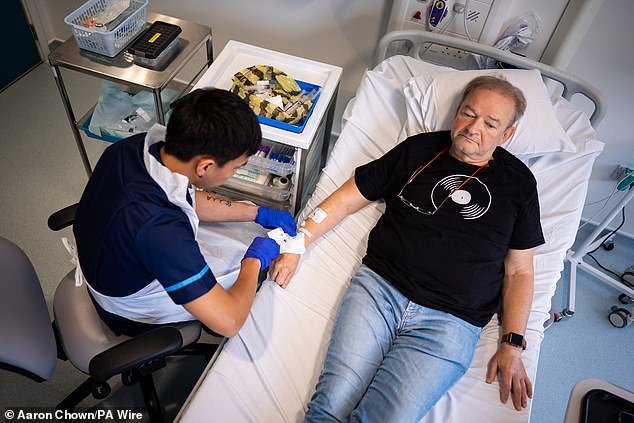
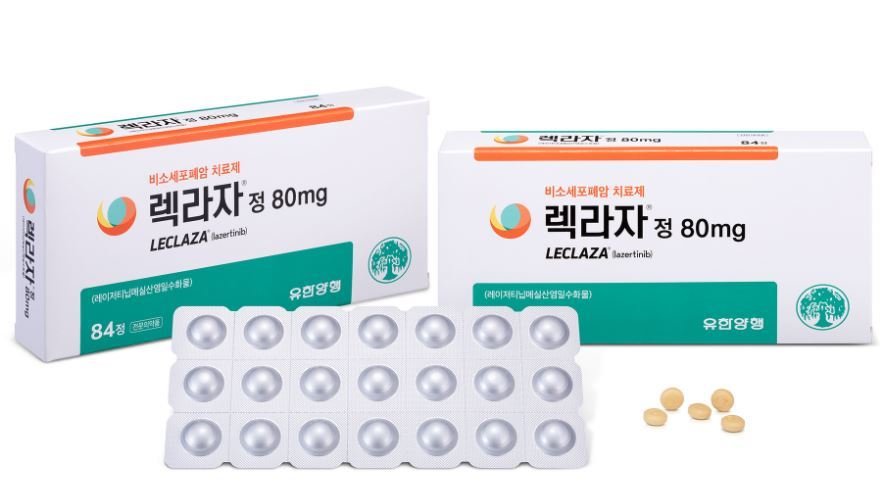
1.Cách đây 8 tháng mình đã từng bàn về hiệu quả của phác đồ gộp Thuốc Amivantamab+ Thuốc đích EGFR th3 Lazertinib. Hôm nay, chúng ta trở lại phác đồ gộp này với thông tin không thể vui hơn khi nó đã trở thành tiêu chuẩn chính thức trong chăm sóc và điều trị bệnh nhân ung thư phổi!
2. Cách đây chưa đầy 12 tiếng, tức vào cùng ngày 20/8/2024, Tập đoàn dược phẩm Johnson & Johnson đã ra thông cáo báo chí về việc Cục quản lý thực phẩm và dược phẩm Hoa Kỳ FDA đã phê duyệt phác đồ gộp Thuốc Amivantamab+ Thuốc đích EGFR th3 Lazertinib trong điều trị BƯỚC ĐẦU cho bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn di căn hoặc tiến triển cục bộ dương tính đột biến gen EGFR EXON19 hoặc L858R.
Việc phê duyệt này được thông qua sau thành công ở phase3 của Nghiên cứu MARIPOSA. Nghiên cứu MARIPOSA được thiết kế để so sánh đối đầu giữa Phác đồ gộp Amivantamab+ Lazertinib với Thuốc đích thế hệ 3 Osimertinib khi dùng làm điều trị bước đầu cho những bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn tiến triển cục bộ hoặc di căn dương tính đột biến gen EGFR.
Kết quả nghiên cứu chỉ ra:
=>> Trung vị thời gian sống không bệnh tiến triển của phác đồ gộp Amivantamab+ Lazertinib VƯỢT TRỘI so với Thuốc đích Osimertinib, cụ thể là 23.7 tháng so với 16.6 tháng!
=>> Trung vị thời gian duy trì đáp ứng của phác đồ gộp Amivantamab+ Lazertinib VƯỢT TRỘI so với Thuốc đích Osimertinib, cụ thể là 25.8 tháng so với 16.7 tháng!
=>> Hiện dữ liệu sống còn toàn bộ chưa hoàn thiện.
Với cột mốc này, Phác đồ gộp Amivantamab+ Lazertinib đã trở thành phác đồ KO hoá trị ĐẦU TIÊN và DUY NHẤT vượt mặt Thuốc đích th3 Osimertinib trong điều trị bước đầu cho bệnh nhân ung thư phổi không tế bào nhỏ tính đến thời điểm này!!!
QUAN ĐIỂM CỦA CHUYÊN GIA:
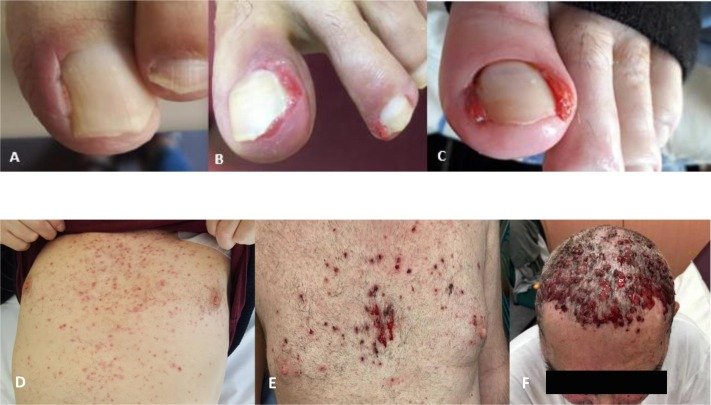
=>> Nhiều lựa chọn hơn đồng nghĩa với việc nhiều hy vọng hơn! Các bạn có thay đổi chiến lược điều trị của mình sau phê duyệt này từ FDA không? Tôi thì chưa! Phác đồ gộp mang đến sự vượt trội về thời gian sống không bệnh tiến triển nhưng đi kèm với đó là độc tố tăng trong khi dữ liệu về sống còn toàn bộ hiện vẫn chưa có. Dĩ nhiên, với một số nhóm bệnh nhân chọn lọc có nguy cơ cao thì phác đồ gộp này sẽ là một lựa chọn lý tưởng.
=>> Đồng ý với bạn! Một số bệnh nhân mang những yếu tố nguy cơ cao có thể là đối tượng lý tưởng cho phác đồ gộp này. Có thể kể đến những bệnh nhân như DI CĂN NÃO, DI CĂN GAN, DƯƠNG TÍNH ĐỘT BIẾN GEN TP53 hoặc dương tính ctDNA! Tôi sẽ trao đổi với bệnh nhân trước khi đi đến quyết định lựa chọn phác đồ cho họ!
Chúc mừng cộng đồng ung thư phổi! Vũ khí nhiều hơn- cuộc chiến cũng sẽ dễ dàng hơn!!

 www.facebook.com
www.facebook.com

1.Cách đây 8 tháng mình đã từng bàn về hiệu quả của phác đồ gộp Thuốc Amivantamab+ Thuốc đích EGFR th3 Lazertinib. Hôm nay, chúng ta trở lại phác đồ gộp này với thông tin không thể vui hơn khi nó đã trở thành tiêu chuẩn chính thức trong chăm sóc và điều trị bệnh nhân ung thư phổi!
2. Cách đây chưa đầy 12 tiếng, tức vào cùng ngày 20/8/2024, Tập đoàn dược phẩm Johnson & Johnson đã ra thông cáo báo chí về việc Cục quản lý thực phẩm và dược phẩm Hoa Kỳ FDA đã phê duyệt phác đồ gộp Thuốc Amivantamab+ Thuốc đích EGFR th3 Lazertinib trong điều trị BƯỚC ĐẦU cho bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn di căn hoặc tiến triển cục bộ dương tính đột biến gen EGFR EXON19 hoặc L858R.
Việc phê duyệt này được thông qua sau thành công ở phase3 của Nghiên cứu MARIPOSA. Nghiên cứu MARIPOSA được thiết kế để so sánh đối đầu giữa Phác đồ gộp Amivantamab+ Lazertinib với Thuốc đích thế hệ 3 Osimertinib khi dùng làm điều trị bước đầu cho những bệnh nhân ung thư phổi không tế bào nhỏ giai đoạn tiến triển cục bộ hoặc di căn dương tính đột biến gen EGFR.
Kết quả nghiên cứu chỉ ra:
=>> Trung vị thời gian sống không bệnh tiến triển của phác đồ gộp Amivantamab+ Lazertinib VƯỢT TRỘI so với Thuốc đích Osimertinib, cụ thể là 23.7 tháng so với 16.6 tháng!
=>> Trung vị thời gian duy trì đáp ứng của phác đồ gộp Amivantamab+ Lazertinib VƯỢT TRỘI so với Thuốc đích Osimertinib, cụ thể là 25.8 tháng so với 16.7 tháng!
=>> Hiện dữ liệu sống còn toàn bộ chưa hoàn thiện.
Với cột mốc này, Phác đồ gộp Amivantamab+ Lazertinib đã trở thành phác đồ KO hoá trị ĐẦU TIÊN và DUY NHẤT vượt mặt Thuốc đích th3 Osimertinib trong điều trị bước đầu cho bệnh nhân ung thư phổi không tế bào nhỏ tính đến thời điểm này!!!
QUAN ĐIỂM CỦA CHUYÊN GIA:
=>> Nhiều lựa chọn hơn đồng nghĩa với việc nhiều hy vọng hơn! Các bạn có thay đổi chiến lược điều trị của mình sau phê duyệt này từ FDA không? Tôi thì chưa! Phác đồ gộp mang đến sự vượt trội về thời gian sống không bệnh tiến triển nhưng đi kèm với đó là độc tố tăng trong khi dữ liệu về sống còn toàn bộ hiện vẫn chưa có. Dĩ nhiên, với một số nhóm bệnh nhân chọn lọc có nguy cơ cao thì phác đồ gộp này sẽ là một lựa chọn lý tưởng.
=>> Đồng ý với bạn! Một số bệnh nhân mang những yếu tố nguy cơ cao có thể là đối tượng lý tưởng cho phác đồ gộp này. Có thể kể đến những bệnh nhân như DI CĂN NÃO, DI CĂN GAN, DƯƠNG TÍNH ĐỘT BIẾN GEN TP53 hoặc dương tính ctDNA! Tôi sẽ trao đổi với bệnh nhân trước khi đi đến quyết định lựa chọn phác đồ cho họ!
Chúc mừng cộng đồng ung thư phổi! Vũ khí nhiều hơn- cuộc chiến cũng sẽ dễ dàng hơn!!

CHIẾN THẮNG UNG THƯ PHỔI | Facebook
CẬP NHẬT NHỮNG TIẾN BỘ MỚI NHẤT TRÊN THẾ GIỚI VỀ UNG THƯ PHỔI.
 www.facebook.com
www.facebook.com