- Biển số
- OF-359543
- Ngày cấp bằng
- 23/3/15
- Số km
- 1,090
- Động cơ
- 266,381 Mã lực
BÀI SỐ 500: BÀN VỀ ĐIỀU TRỊ KHÁNG THUỐC CHO BỆNH NHÂN UNG THƯ PHỔI TẾ BÀO NHỎ: THUỐC TEMOZOLOMIDE CÓ LÀ MỘT LỰA CHỌN HỢP LÝ ?
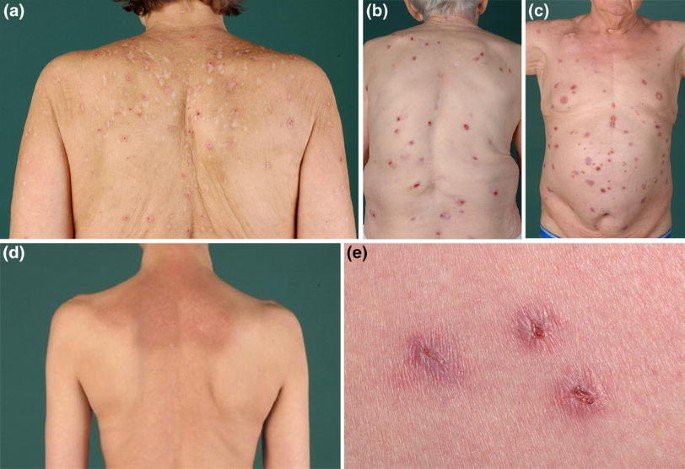
1.Ung thư phổi tế bào nhỏ là một căn bệnh tàn khốc. Bất chấp việc bệnh nhân có thể đáp ứng với phác đồ Hoá trị Etoposide platinum ở ngay điều trị BƯỚC ĐẦU thì HẦU HẾT bệnh sẽ tái phát quay trở lại chỉ trong vòng 6 tháng sau đó !
Chiến lược trị kháng dành cho bệnh nhân ung thư phổi tế bào nhỏ lúc này thực sự là một thách thức. Hiện ở Châu Âu, Topotecan là thuốc duy nhất được phê duyệt làm tiêu chuẩn điều trị ở BƯỚC HAI đối với bệnh nhân ung thư phổi tế bào nhỏ. Dù vậy, hiệu quả khiêm tốn và độc tính cao của Topotecan đã khiến bức tranh sống còn của bệnh nhân ung thư phổi tế bào nhỏ trở nên thực sự ảm đạm.
Từ đây, nhiều chiến lược điều trị khác đang được lên kế hoạch nhằm thay thế vai trò của Topotecan. Hôm nay, chúng ta sẽ bàn đến một trong những chiến lược như vậy: Thuốc Temozolomide !
2. Vào ngày 13/4/2025, Chuyên gia Sofie Dhaeyer cùng các đồng nghiệp đã công bố hiệu quả của Thuốc Temozolomide khi điều trị cho những bệnh nhân ung thư phổi tế bào nhỏ có bệnh tái phát ở trong thế giới thực. Bệnh nhân trong nghiên cứu sẽ được dùng Temozolomide liều 250mg uống mỗi ngày một lần từ ngày 1 cho đến ngày 5 trong mỗi chu kỳ điều trị 28 ngày.
Trong thời gian 12 năm, kể từ tháng 2/2011 cho đến tháng 5/2023, tổng cộng 48 bệnh nhân đủ điều kiện đã được tuyển vô nghiên cứu. Trong đó:
-> Trung vị tuổi của bệnh nhân trong nghiên cứu là 61.
-> ĐA SỐ bệnh nhân trong nghiên cứu đều đã trải qua NHIỀU phác đồ điều trị trước đó. Có tới 57.4% bệnh nhân trong nghiên cứu trước đó đã trải qua ít nhất 2 phác đồ điều trị.
Kết quả phân tích cho thấy:
=>> Tỷ lệ đáp ứng khách quan đạt 14.9%
=>> Tỷ lệ kiểm soát bệnh đạt 23.4%.
=>> Trung vị thời gian sống không bệnh tiến triển đạt 1.7 tháng.
=>> Trung vị thời gian sống còn toàn bộ đạt 3.2 tháng.
=>> Tỷ lệ bệnh nhân mắc tác dụng phụ mức độ 3 hoặc 4 là 34%.
Nhóm nghiên cứu kết luận:” Thuốc Temozolomide cho hiệu quả KHIÊM TỐN khi điều trị cho những bệnh nhân ung thư phổi tế bào nhỏ có bệnh tái phát. Dù vậy, khi so sánh với tiêu chuẩn điều trị là thuốc Topotecan thì Temozolomide cho tỷ lệ đáp ứng tương đương với hồ sơ độc tính nhẹ hơn. Do đó, thuốc Temozolomide có thể là một chiến lược điều trị thay thế cho thuốc Topotecan trong trường hợp bệnh nhân ung thư phổi tế bào nhỏ tái phát bệnh”.

 www.facebook.com
www.facebook.com

1.Ung thư phổi tế bào nhỏ là một căn bệnh tàn khốc. Bất chấp việc bệnh nhân có thể đáp ứng với phác đồ Hoá trị Etoposide platinum ở ngay điều trị BƯỚC ĐẦU thì HẦU HẾT bệnh sẽ tái phát quay trở lại chỉ trong vòng 6 tháng sau đó !
Chiến lược trị kháng dành cho bệnh nhân ung thư phổi tế bào nhỏ lúc này thực sự là một thách thức. Hiện ở Châu Âu, Topotecan là thuốc duy nhất được phê duyệt làm tiêu chuẩn điều trị ở BƯỚC HAI đối với bệnh nhân ung thư phổi tế bào nhỏ. Dù vậy, hiệu quả khiêm tốn và độc tính cao của Topotecan đã khiến bức tranh sống còn của bệnh nhân ung thư phổi tế bào nhỏ trở nên thực sự ảm đạm.
Từ đây, nhiều chiến lược điều trị khác đang được lên kế hoạch nhằm thay thế vai trò của Topotecan. Hôm nay, chúng ta sẽ bàn đến một trong những chiến lược như vậy: Thuốc Temozolomide !
2. Vào ngày 13/4/2025, Chuyên gia Sofie Dhaeyer cùng các đồng nghiệp đã công bố hiệu quả của Thuốc Temozolomide khi điều trị cho những bệnh nhân ung thư phổi tế bào nhỏ có bệnh tái phát ở trong thế giới thực. Bệnh nhân trong nghiên cứu sẽ được dùng Temozolomide liều 250mg uống mỗi ngày một lần từ ngày 1 cho đến ngày 5 trong mỗi chu kỳ điều trị 28 ngày.
Trong thời gian 12 năm, kể từ tháng 2/2011 cho đến tháng 5/2023, tổng cộng 48 bệnh nhân đủ điều kiện đã được tuyển vô nghiên cứu. Trong đó:
-> Trung vị tuổi của bệnh nhân trong nghiên cứu là 61.
-> ĐA SỐ bệnh nhân trong nghiên cứu đều đã trải qua NHIỀU phác đồ điều trị trước đó. Có tới 57.4% bệnh nhân trong nghiên cứu trước đó đã trải qua ít nhất 2 phác đồ điều trị.
Kết quả phân tích cho thấy:
=>> Tỷ lệ đáp ứng khách quan đạt 14.9%
=>> Tỷ lệ kiểm soát bệnh đạt 23.4%.
=>> Trung vị thời gian sống không bệnh tiến triển đạt 1.7 tháng.
=>> Trung vị thời gian sống còn toàn bộ đạt 3.2 tháng.
=>> Tỷ lệ bệnh nhân mắc tác dụng phụ mức độ 3 hoặc 4 là 34%.
Nhóm nghiên cứu kết luận:” Thuốc Temozolomide cho hiệu quả KHIÊM TỐN khi điều trị cho những bệnh nhân ung thư phổi tế bào nhỏ có bệnh tái phát. Dù vậy, khi so sánh với tiêu chuẩn điều trị là thuốc Topotecan thì Temozolomide cho tỷ lệ đáp ứng tương đương với hồ sơ độc tính nhẹ hơn. Do đó, thuốc Temozolomide có thể là một chiến lược điều trị thay thế cho thuốc Topotecan trong trường hợp bệnh nhân ung thư phổi tế bào nhỏ tái phát bệnh”.

CHIẾN THẮNG UNG THƯ PHỔI | Facebook
CẬP NHẬT NHỮNG TIẾN BỘ MỚI NHẤT TRÊN THẾ GIỚI VỀ UNG THƯ PHỔI.
 www.facebook.com
www.facebook.com