- Biển số
- OF-359543
- Ngày cấp bằng
- 23/3/15
- Số km
- 973
- Động cơ
- 266,314 Mã lực
BÀI SỐ 388: KỶ NGUYÊN PHÁT TRIỂN KỸ THUẬT TIÊM DƯỚI DA NHẰM THAY THẾ CHO TRUYỀN TĨNH MẠCH.
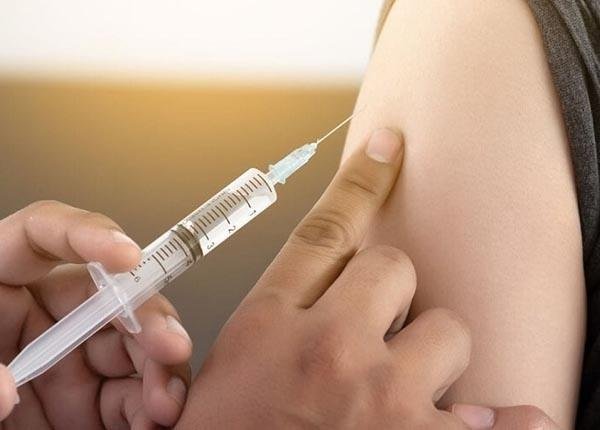
1.Chủ đề thay thế truyền tĩnh mạch bằng kỹ thuật tiêm dưới da đã được mình bàn đến cách đây 2 năm. Qua các bài viết đó chúng ta thấy rằng kỹ thuật tiêm dưới da đã rút ngắn thời gian điều trị xuống chỉ còn 7 phút so với 40 phút của truyền tĩnh mạch.
Ngoài lợi thế rút ngắn thời gian điều trị so với truyền tĩnh mạch, Tiêm dưới da còn giúp bệnh nhân cảm thấy thoải mái hơn, ít đau hơn và đặc biệt là cách thức điều trị mới sẽ giảm áp lực lên hệ thống y tế.
Thuốc Enhertu được mình bàn lần đầu tiên trên nhóm cách đây 2 năm, Enhertu là THUỐC ĐẦU TIÊN điều trị đột biến HER2 được thông qua dùng trong ung thư phổi không tế bào nhỏ. Năm ngoái, doanh thu bán Enhertu trên toàn cầu đạt 2.78 tỷ đô!!! Mặc dù sở hữu hiệu quả điều trị rất tốt nhưng bản thân Enhertu là thuốc truyền tĩnh mạch vs KO ít tác dụng phụ. Vậy có thể phát triển một công nghệ mới cho phép chuyển Enhertu từ truyền tĩnh mạch sang tiêm dưới da? Nếu việc này thành công- người được hưởng lợi nhiều nhất chính là bệnh nhân khi chuyện điều trị sẽ trở nên nhẹ nhàng hơn rất nhiều.
2. Vào ngày 8/11/2024, Tập đoàn sinh học Alteogen ra thông báo đã ký thoả thuận với Tập đoàn dược phẩm Daiichi Sankyo trong việc cấp giấy phép độc quyền sử dụng ALT-B4 cho phát triển kỹ thuật tiêm dưới da của Thuốc Enhertu. Tổng giá trị của hợp đồng là khoảng 300 triệu đô, trong đó có 20 triệu đô trả trước.
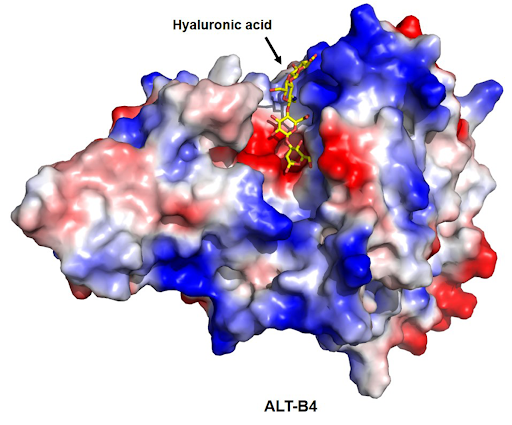
ALT-B4 là một enzyme do Tập đoàn AIteogen tự nghiên cứu và phát triển. ALT-B4 được kỳ vọng sẽ giúp Enhertu có thể chuyển từ truyền tĩnh mạch sang tiêm dưới da. Tập đoàn AIteogen hiện đã ký thoả thuận hợp tác vs 4 Tập đoàn khác trong việc xuất khẩu công nghệ độc quyền của ALT-B4.
Chúng ta cùng chờ xem!

 www.facebook.com
www.facebook.com
1.Chủ đề thay thế truyền tĩnh mạch bằng kỹ thuật tiêm dưới da đã được mình bàn đến cách đây 2 năm. Qua các bài viết đó chúng ta thấy rằng kỹ thuật tiêm dưới da đã rút ngắn thời gian điều trị xuống chỉ còn 7 phút so với 40 phút của truyền tĩnh mạch.
Ngoài lợi thế rút ngắn thời gian điều trị so với truyền tĩnh mạch, Tiêm dưới da còn giúp bệnh nhân cảm thấy thoải mái hơn, ít đau hơn và đặc biệt là cách thức điều trị mới sẽ giảm áp lực lên hệ thống y tế.
Thuốc Enhertu được mình bàn lần đầu tiên trên nhóm cách đây 2 năm, Enhertu là THUỐC ĐẦU TIÊN điều trị đột biến HER2 được thông qua dùng trong ung thư phổi không tế bào nhỏ. Năm ngoái, doanh thu bán Enhertu trên toàn cầu đạt 2.78 tỷ đô!!! Mặc dù sở hữu hiệu quả điều trị rất tốt nhưng bản thân Enhertu là thuốc truyền tĩnh mạch vs KO ít tác dụng phụ. Vậy có thể phát triển một công nghệ mới cho phép chuyển Enhertu từ truyền tĩnh mạch sang tiêm dưới da? Nếu việc này thành công- người được hưởng lợi nhiều nhất chính là bệnh nhân khi chuyện điều trị sẽ trở nên nhẹ nhàng hơn rất nhiều.
2. Vào ngày 8/11/2024, Tập đoàn sinh học Alteogen ra thông báo đã ký thoả thuận với Tập đoàn dược phẩm Daiichi Sankyo trong việc cấp giấy phép độc quyền sử dụng ALT-B4 cho phát triển kỹ thuật tiêm dưới da của Thuốc Enhertu. Tổng giá trị của hợp đồng là khoảng 300 triệu đô, trong đó có 20 triệu đô trả trước.
ALT-B4 là một enzyme do Tập đoàn AIteogen tự nghiên cứu và phát triển. ALT-B4 được kỳ vọng sẽ giúp Enhertu có thể chuyển từ truyền tĩnh mạch sang tiêm dưới da. Tập đoàn AIteogen hiện đã ký thoả thuận hợp tác vs 4 Tập đoàn khác trong việc xuất khẩu công nghệ độc quyền của ALT-B4.
Chúng ta cùng chờ xem!

CHIẾN THẮNG UNG THƯ PHỔI | Facebook
CẬP NHẬT NHỮNG TIẾN BỘ MỚI NHẤT TRÊN THẾ GIỚI VỀ UNG THƯ PHỔI.
 www.facebook.com
www.facebook.com