- Biển số
- OF-720718
- Ngày cấp bằng
- 18/3/20
- Số km
- 352
- Động cơ
- 81,940 Mã lực
Vội làm gì đợi version sau có hàng mẫu quốc sẵn sàng.

 baotintuc.vn
baotintuc.vn
Ngày 12/3, Tập đoàn dược phẩm Sanofi của Pháp và hãng công nghệ sinh học Translate Bio của Mỹ thông báo đã bắt đầu thử nghiệm trên người ứng cử viên vaccine ngừa bệnh viêm đường hô hấp cấp COVID-19 dựa trên công nghệ mRNA (mang thông tin di truyền).

Nhân viên làm việc tại dây chuyền sản xuất vaccine ngừa COVID-19 của công ty dược phẩm Sanofi ở Val-de-Reuil,
Pháp. Ảnh: AFP/TTXVN
Đây là dự án vaccine ngừa COVID-19 thứ hai của Sanofi và cũng là ứng cử viên vaccine mới nhất dựa trên công nghệ mới mRNA.
Trong tuyên bố, Sanofi và Translate Bio cho biết các cuộc thử nghiệm giai đoạn 1 và 2 sẽ bao gồm 415 người trưởng thành khỏe mạnh tại 13 khu vực. Các cuộc thử nghiệm này nhằm mục đích đánh giá độ an toàn của vaccine, cũng như cung cấp thông tin ban đầu về tính hiệu quả của chế phẩm này.
Tình nguyện viên sẽ được chủng ngừa một liều duy nhất hoặc 2 liều cách nhau 21 ngày trong khi việc tiêm 3 mũi sẽ được xem xét. Giai đoạn 3 sẽ được thực hiện trên nhiều bệnh nhân hơn nhằm đánh giá độ hiệu quả của vaccine. Kết quả thử nghiệm ban đầu dự kiến sẽ được công bố trong quý III tới.
Tháng 6 năm ngoái, Sanofi thông báo sẽ tiếp tục đầu tư 425 triệu USD, trong khuôn khổ thỏa thuận mới trị giá có thể lên tới 2 tỷ USD, để mở rộng liên doanh với công ty khởi nghiệp Translate Bio nhằm tìm ra vaccine ngừa COVID-19 vào năm 2021.
Hai công ty này đã hợp tác từ năm 2018 nhằm thúc đẩy dự án của Translate Bio phát triển các loại thuốc sử dụng công nghệ mRNA giúp các tế bào tạo ra một loại protein chống lại các bệnh tật. Ngoài việc hợp tác với Translate Bio nhằm phát triển ứng cử viên vaccine mRNA, Sanofi cũng đang hợp tác với hãng dược phẩm GlaxoSmithKline (GSK) của Anh để phát triển loại vaccine trên nền tảng phát triển các vaccine ngừa bệnh cúm nhằm cải thiện hiệu quả của chế phẩm này.
Vaccine mRNA hoạt động bằng cách mô phỏng theo các tác nhân gây bệnh để kích thích hệ thống miễn dịch; xây dựng cơ chế phòng vệ hoạt động trong cơ thể nhằm chống lại các bệnh truyền nhiễm trong tương lai.
Vaccine mRNA mang đến cách tiếp cận sáng tạo bằng cách cung cấp một chuỗi nucleotide mã hóa một hoặc nhiều kháng nguyên được chọn có tiềm năng cao để tạo ra phản ứng miễn dịch bảo vệ. Công nghệ mRNA cũng đã được sử dụng trong việc bào chế vaccine của hãng Pfizer (Mỹ)/BioNTech (Đức) và Moderna (Mỹ). Hai loại vaccine này đã được cấp phép sử dụng tại Liên minh châu Âu (EU) và Mỹ cùng những nước khác.
* Cùng ngày, Cơ quan quản lý dược phẩm Nam Phi (SAHPRA) cho biết đã tiếp nhận tài liệu về vaccine ngừa COVID-19 do hãng dược phẩm Sinovac của Trung Quốc phát triển. Cơ quan này cho biết sẽ bắt đầu đánh giá dữ liệu và mức độ hiệu quả của vaccine này.
 thanhnien.vn
thanhnien.vn

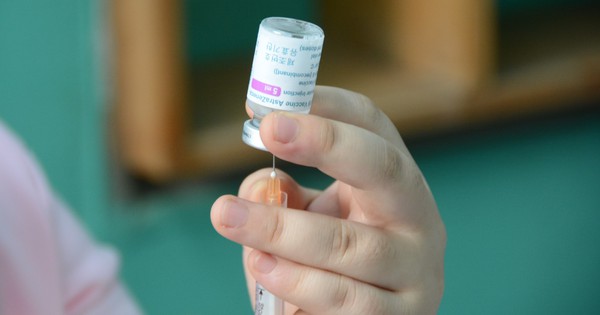
Vắc xin Covid-19
ẢNH: DUY TÍNH
Ngày 17.3, Trung tâm kiểm soát bệnh tật TP.HCM (HCDC) cho biết tính đến ngày 16.3, 824 nhân viên y tế của Bệnh viện Bệnh Nhiệt đới TP.HCM đã được tiêm vắc xin Covid-19 do AstraZeneca/SKBio sản xuất. Trong đó ghi nhận những trường hợp có phản ứng thông thường sau tiêm vắc xin Covid-19, bao gồm: sưng đau tại chỗ tiêm, đau cơ, đau đầu, sốt, đau khớp, bồn chồn, khó chịu, ớn lạnh, chóng mặt, tiêu chảy, đau họng.
Ngoài những phản ứng thông thường thì ghi nhận thêm 6 trường hợp có triệu chứng khác 1 ca huyết áp kẹp, 2 ca tiêu chảy độ trung bình và 3 ca phản ứng phản vệ độ II.
Ngay sau khi ghi nhận những trường hợp phản ứng sau tiêm, HCDC đã tổ chức điều tra, đánh giá nguyên nhân sự cố bất lợi sau tiêm chủng tại Bệnh viện Bệnh nhiệt đới. Sở Y tế TP.HCM cũng đã tổ chức họp hội đồng tư vấn chuyên môn đánh giá nguyên nhân sự cố bất lợi sau tiêm chủng đối với 3 trường hợp phản ứng phản vệ độ II.
Đã tiêm chủng cho tổng cộng 20.695 người
Hội đồng tư vấn chuyên môn kết luận 3 trường hợp phản vệ độ II sau tiêm vắc xin Covid-19 tại Bệnh viện Bệnh Nhiệt đới được điều trị kịp thời, diễn tiến ổn định, xuất viện sau 24 giờ.
Về quy trình bảo quản, vận chuyển vắc xin, thực hành tiêm chủng an toàn và xử trí sau tiêm chủng của Bệnh viện Bệnh Nhiệt đới thực hiện đúng quy định của Bộ Y tế.
Tỷ lệ phản ứng thông thường xảy ra sau tiêm vắc xin Covid-19 tại Bệnh viện Bệnh Nhiệt đới được báo cáo tương tự như thông báo của nhà sản xuất AstraZeneca và những nghiên cứu lâm sàng trên thế giới. Không riêng vắc xin Covid-19 do AstraZeneca sản xuất, hầu hết các loại vắc xin khác cũng đều có phản ứng sau tiêm với một tỉ lệ nhất định.
Qua kinh nghiệm phát hiện và xử trí 3 trường hợp phản ứng phản vệ độ 2 sau tiêm chủng tại Bệnh viện bệnh Nhiệt đới, Sở Y tế chỉ đạo HCDC khẩn trương tổ chức tập huấn hướng dẫn triển khai tiêm chiến dịch vắc xin phòng bệnh Covid-19 cho các cơ sở tiêm chủng sắp tới, đảm bảo việc tổ chức tiêm chủng an toàn.
Nhân viên y tế sau tiêm chủng phải được theo dõi đúng quy định nhằm phát hiện sớm và xử trí kịp thời những phản ứng có thể xảy ra.
Các cơ sở tiêm chủng đặc biệt lưu ý hướng dẫn những người được tiêm chủng theo dõi tại điểm tiêm ít nhất 30 phút và hướng dẫn họ tiếp tục tự theo dõi sức khỏe tại nhà. Đồng thời mỗi cơ sở tiêm chủng chủ động hoặc phối hợp với các bệnh viện trên địa bàn tổ chức đội cấp cứu tại đơn vị trong buổi tiêm chủng, có quy trình xử trí cấp cứu rõ ràng để sẵn sàng xử trí ngay khi xảy ra sự cố bất lợi sau tiêm chủng.
Theo thông tin từ Bộ Y tế thì cả nước hiện đã tiêm chủng cho tổng cộng 20.695 người, trong đó có 4.078 người có phản ứng thông thường sau tiêm. Một số ít người phản ứng phản vệ độ II, III đã được xử lý và đều ổn định sức khoẻ.
Theo HCDC, thời gian tới, việc kiểm soát dịch Covid-19 phụ thuộc nhiều vào việc phát triển vắc xin. Tuy nhiên, nguồn cung ứng vắc xin nhập khẩu còn hạn chế và dự kiến đến năm 2022, vắc xin Covid-19 do Việt Nam sản xuất mới được đưa vào sử dụng. Theo đó, Bộ Y tế khuyến cáo tiếp tục duy trì các biện pháp phòng, chống dịch đơn giản, kinh tế và hiệu quả theo thông điệp 5K.

Sanofi bắt đầu thử nghiệm trên người loại vaccine dựa trên công nghệ mRNA
Ngày 12/3, Tập đoàn dược phẩm Sanofi của Pháp và hãng công nghệ sinh học Translate Bio của Mỹ thông báo đã bắt đầu thử nghiệm trên người ứng cử viên vaccine ngừa bệnh viêm đường hô hấp cấp COVID-19 dựa trên công nghệ mRNA (mang thông tin di truyền).
Ngày 12/3, Tập đoàn dược phẩm Sanofi của Pháp và hãng công nghệ sinh học Translate Bio của Mỹ thông báo đã bắt đầu thử nghiệm trên người ứng cử viên vaccine ngừa bệnh viêm đường hô hấp cấp COVID-19 dựa trên công nghệ mRNA (mang thông tin di truyền).

Nhân viên làm việc tại dây chuyền sản xuất vaccine ngừa COVID-19 của công ty dược phẩm Sanofi ở Val-de-Reuil,
Pháp. Ảnh: AFP/TTXVN
Đây là dự án vaccine ngừa COVID-19 thứ hai của Sanofi và cũng là ứng cử viên vaccine mới nhất dựa trên công nghệ mới mRNA.
Trong tuyên bố, Sanofi và Translate Bio cho biết các cuộc thử nghiệm giai đoạn 1 và 2 sẽ bao gồm 415 người trưởng thành khỏe mạnh tại 13 khu vực. Các cuộc thử nghiệm này nhằm mục đích đánh giá độ an toàn của vaccine, cũng như cung cấp thông tin ban đầu về tính hiệu quả của chế phẩm này.
Tình nguyện viên sẽ được chủng ngừa một liều duy nhất hoặc 2 liều cách nhau 21 ngày trong khi việc tiêm 3 mũi sẽ được xem xét. Giai đoạn 3 sẽ được thực hiện trên nhiều bệnh nhân hơn nhằm đánh giá độ hiệu quả của vaccine. Kết quả thử nghiệm ban đầu dự kiến sẽ được công bố trong quý III tới.
Tháng 6 năm ngoái, Sanofi thông báo sẽ tiếp tục đầu tư 425 triệu USD, trong khuôn khổ thỏa thuận mới trị giá có thể lên tới 2 tỷ USD, để mở rộng liên doanh với công ty khởi nghiệp Translate Bio nhằm tìm ra vaccine ngừa COVID-19 vào năm 2021.
Hai công ty này đã hợp tác từ năm 2018 nhằm thúc đẩy dự án của Translate Bio phát triển các loại thuốc sử dụng công nghệ mRNA giúp các tế bào tạo ra một loại protein chống lại các bệnh tật. Ngoài việc hợp tác với Translate Bio nhằm phát triển ứng cử viên vaccine mRNA, Sanofi cũng đang hợp tác với hãng dược phẩm GlaxoSmithKline (GSK) của Anh để phát triển loại vaccine trên nền tảng phát triển các vaccine ngừa bệnh cúm nhằm cải thiện hiệu quả của chế phẩm này.
Vaccine mRNA hoạt động bằng cách mô phỏng theo các tác nhân gây bệnh để kích thích hệ thống miễn dịch; xây dựng cơ chế phòng vệ hoạt động trong cơ thể nhằm chống lại các bệnh truyền nhiễm trong tương lai.
Vaccine mRNA mang đến cách tiếp cận sáng tạo bằng cách cung cấp một chuỗi nucleotide mã hóa một hoặc nhiều kháng nguyên được chọn có tiềm năng cao để tạo ra phản ứng miễn dịch bảo vệ. Công nghệ mRNA cũng đã được sử dụng trong việc bào chế vaccine của hãng Pfizer (Mỹ)/BioNTech (Đức) và Moderna (Mỹ). Hai loại vaccine này đã được cấp phép sử dụng tại Liên minh châu Âu (EU) và Mỹ cùng những nước khác.
* Cùng ngày, Cơ quan quản lý dược phẩm Nam Phi (SAHPRA) cho biết đã tiếp nhận tài liệu về vaccine ngừa COVID-19 do hãng dược phẩm Sinovac của Trung Quốc phát triển. Cơ quan này cho biết sẽ bắt đầu đánh giá dữ liệu và mức độ hiệu quả của vaccine này.
Phương Oanh (TTXVN)

Kết luận phản ứng sau tiêm vắc xin Covid-19 tại TP.HCM
3 trường hợp phản vệ độ II sau tiêm vắc xin Covid-19 tại Bệnh viện Bệnh Nhiệt đới được điều trị kịp thời, diễn tiến ổn định, xuất viện sau 24 giờ.

Vắc xin Covid-19
ẢNH: DUY TÍNH
Ngày 17.3, Trung tâm kiểm soát bệnh tật TP.HCM (HCDC) cho biết tính đến ngày 16.3, 824 nhân viên y tế của Bệnh viện Bệnh Nhiệt đới TP.HCM đã được tiêm vắc xin Covid-19 do AstraZeneca/SKBio sản xuất. Trong đó ghi nhận những trường hợp có phản ứng thông thường sau tiêm vắc xin Covid-19, bao gồm: sưng đau tại chỗ tiêm, đau cơ, đau đầu, sốt, đau khớp, bồn chồn, khó chịu, ớn lạnh, chóng mặt, tiêu chảy, đau họng.
Ngoài những phản ứng thông thường thì ghi nhận thêm 6 trường hợp có triệu chứng khác 1 ca huyết áp kẹp, 2 ca tiêu chảy độ trung bình và 3 ca phản ứng phản vệ độ II.
Ngay sau khi ghi nhận những trường hợp phản ứng sau tiêm, HCDC đã tổ chức điều tra, đánh giá nguyên nhân sự cố bất lợi sau tiêm chủng tại Bệnh viện Bệnh nhiệt đới. Sở Y tế TP.HCM cũng đã tổ chức họp hội đồng tư vấn chuyên môn đánh giá nguyên nhân sự cố bất lợi sau tiêm chủng đối với 3 trường hợp phản ứng phản vệ độ II.
Đã tiêm chủng cho tổng cộng 20.695 người
Hội đồng tư vấn chuyên môn kết luận 3 trường hợp phản vệ độ II sau tiêm vắc xin Covid-19 tại Bệnh viện Bệnh Nhiệt đới được điều trị kịp thời, diễn tiến ổn định, xuất viện sau 24 giờ.
Về quy trình bảo quản, vận chuyển vắc xin, thực hành tiêm chủng an toàn và xử trí sau tiêm chủng của Bệnh viện Bệnh Nhiệt đới thực hiện đúng quy định của Bộ Y tế.
Tỷ lệ phản ứng thông thường xảy ra sau tiêm vắc xin Covid-19 tại Bệnh viện Bệnh Nhiệt đới được báo cáo tương tự như thông báo của nhà sản xuất AstraZeneca và những nghiên cứu lâm sàng trên thế giới. Không riêng vắc xin Covid-19 do AstraZeneca sản xuất, hầu hết các loại vắc xin khác cũng đều có phản ứng sau tiêm với một tỉ lệ nhất định.
Qua kinh nghiệm phát hiện và xử trí 3 trường hợp phản ứng phản vệ độ 2 sau tiêm chủng tại Bệnh viện bệnh Nhiệt đới, Sở Y tế chỉ đạo HCDC khẩn trương tổ chức tập huấn hướng dẫn triển khai tiêm chiến dịch vắc xin phòng bệnh Covid-19 cho các cơ sở tiêm chủng sắp tới, đảm bảo việc tổ chức tiêm chủng an toàn.
Nhân viên y tế sau tiêm chủng phải được theo dõi đúng quy định nhằm phát hiện sớm và xử trí kịp thời những phản ứng có thể xảy ra.
Các cơ sở tiêm chủng đặc biệt lưu ý hướng dẫn những người được tiêm chủng theo dõi tại điểm tiêm ít nhất 30 phút và hướng dẫn họ tiếp tục tự theo dõi sức khỏe tại nhà. Đồng thời mỗi cơ sở tiêm chủng chủ động hoặc phối hợp với các bệnh viện trên địa bàn tổ chức đội cấp cứu tại đơn vị trong buổi tiêm chủng, có quy trình xử trí cấp cứu rõ ràng để sẵn sàng xử trí ngay khi xảy ra sự cố bất lợi sau tiêm chủng.
Theo thông tin từ Bộ Y tế thì cả nước hiện đã tiêm chủng cho tổng cộng 20.695 người, trong đó có 4.078 người có phản ứng thông thường sau tiêm. Một số ít người phản ứng phản vệ độ II, III đã được xử lý và đều ổn định sức khoẻ.
Theo HCDC, thời gian tới, việc kiểm soát dịch Covid-19 phụ thuộc nhiều vào việc phát triển vắc xin. Tuy nhiên, nguồn cung ứng vắc xin nhập khẩu còn hạn chế và dự kiến đến năm 2022, vắc xin Covid-19 do Việt Nam sản xuất mới được đưa vào sử dụng. Theo đó, Bộ Y tế khuyến cáo tiếp tục duy trì các biện pháp phòng, chống dịch đơn giản, kinh tế và hiệu quả theo thông điệp 5K.
Chỉnh sửa cuối:





 Các bác làm du lịch chuẩn bị thở phào được rồi
Các bác làm du lịch chuẩn bị thở phào được rồi 
 không biết cụ này đâu ra mà biết em từng ăn APC. Lâu lắm rồi ấy. CMG không chơi bao giờ nhé
không biết cụ này đâu ra mà biết em từng ăn APC. Lâu lắm rồi ấy. CMG không chơi bao giờ nhé 

 .
.